P53腫瘍関連遺伝子検査
がん抑制遺伝子
正常細胞にはがんを抑制する遺伝子があり、この遺伝子によって細胞のがん化を防いでいる。
正常細胞とがん細胞を掛け合わせると、その細胞はがん化してしまうように思われる。しかし、実際はがん細胞と正常細胞を掛け合わせても出来上がった細胞はがん化しない。これは正常細胞にがん抑制遺伝子があるためであり、もともとのがん細胞の機能を正常細胞のがん抑制遺伝子によって制御するために起こる。
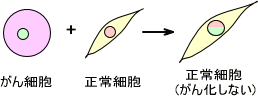
ただし、正常細胞とがん細胞を掛け合わせた細胞では染色体の数が多くなっている。そのため、時間がたつと次第に染色体が脱落していく。このとき、ある時点でがん抑制遺伝子が脱落すると、その細胞はがん化してしまう。
がん抑制遺伝子には様々なものがあるが、その中の一つにRBがある。RBは網膜芽細胞腫を抑制している遺伝子である。網膜芽細胞腫の患者では、このRB遺伝子の部分が変異しているために病気を発症するのである。
なお、両方のがん抑制遺伝子で変異が起こった場合のみ、細胞のがん化が起こる。つまり、片方の染色体のがん抑制遺伝子が欠損しただけではがん化しないのである。このため、変異は劣性である。
がん抑制遺伝子の変異は劣勢だが、がん遺伝子の活性化の場合は話が異なる。転座などによってがん遺伝子が活性化する場合は優性の変異である。
|
がん抑制遺伝子 |
がん遺伝子 |
変異の種類 |
劣性 |
優性 |
細胞の機能 |
抑制 |
活性化 |
変異の回数 |
2回 |
1回 |
RBの機能
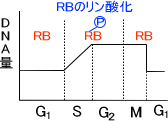
がん抑制遺伝子であるRB遺伝子は細胞分裂に関わっている。RBから転写・翻訳されたタンパク質は細胞分裂を抑制しているのである。
細胞分裂ではS期でDNAの合成が起こる。このとき、RB遺伝子産物はリン酸化されている。通常、RBタンパクはリン酸化されてないが、S期でRB遺伝子産物がリン酸化されて不活性型となる。これによってDNA合成が起こる。(RB遺伝子産物=RBタンパク)
ウイルスが産生するタンパク質の中には、RBタンパク質と親和性が強いものがある。このようなタンパク質を産生するウイルスにヒトパピローマウイルス(HPV)がある。
ヒトパピローマウイルスはRBタンパクと親和性があるたんぱく質を産生することによって、DNAに結合しているRBタンパク質を取り去ってしまう。これは、ウイルスが産生するタンパクとRBタンパクが複合体を形成することによって起こる。
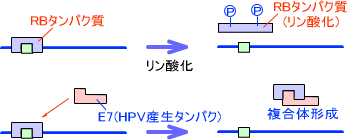
この状態では、RBタンパクがリン酸化されている状況と同じになってしまう。つまり、細胞分裂の制御(DNA合成の制御)が適切に行われなくなってしまうのである。
p53のよるアポトーシスと細胞分裂停止
RB以外のがん抑制遺伝子としてp53がある。p53はDNAの傷を認識する。
p53はDNAの損傷が多い細胞を認識して細胞死を行わせる。細胞死を行うことでがん化する一歩手前の細胞を消し去るのである。このように、生体を適切な状態に保たせるために起こる細胞死をアポトーシスという。
また、p53はDNAの傷を認識してDNA合成を止める働きもしている。この働きによってDNAに傷が出来たまま合成が進むのを抑制するのである。
もし、p53に変異が起こり細胞分裂の停止が行われなかったら、遺伝子に傷ができたままDNA合成が行われてしまう。また、DNA損傷が多い細胞でアポトーシスが行われなくなる。
つまり、がん化する確率が大幅に高くなるのである。
このように、がんは遺伝子の突然変異が蓄積していった結果として起こる。がん抑制遺伝子が欠損すればがん化が起こる。また、がん遺伝子が活性化されてもがん化が起こるのである。
遺伝子治療
文字通り遺伝子の治療であるが、この遺伝子治療にはウイルスが使用される。
ウイルスが増殖するとき、宿主細胞の遺伝子にウイルスの遺伝子を組み込むことで、自身のタンパクを合成させる。この作用を逆に利用して、特定の遺伝子をウイルスによって細胞内に組み込ませるように仕向けるのである。
このように遺伝子を運ぶ働きをするウイルスをベクターという。
ウイルスは病原性をなくしたものを使用する。ベクターは細胞に感染し、自身のもつ遺伝子を感染細胞のDNAに取り込ませる。
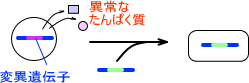
また、遺伝子治療には二種類あり、異常なたんぱく質が発現しているかどうかで治療方法が異なる。
・異常なたんぱく質が発現している場合
細胞ががん化し、さらに異常なたんぱく質も発現している場合、変異遺伝子そのものを置き換える必要がある。これによって、細胞は正常な状態に戻る。
・異常なたんぱく質が発現していない場合
細胞ががん化しているだけで、異常なたんぱく質が発現していない場合、正常な遺伝子を導入するだけで効果がある。これによって、細胞は正常な状態に戻る。
遺伝子治療の方法
遺伝子治療の方法にはin vitroとex vitoの二種類がある。in vitroでは、患者に遺伝子を組み込んだベクターに感染させる。これによって、体内の細胞に遺伝子を組み込ませる。
ex vitroでは、患者の細胞を一旦外に出してからベクターに感染させる。遺伝子を組み込ませた後、再び患者の体内に細胞を戻すのである。この方法がex
vitroである。
がんに対する免疫
がん細胞は、その腫瘍に特異的な腫瘍特異抗原を発現している。この抗原とMHC分子が複合体を形成し、細胞表面に提示される。
この複合体をキラーT細胞が認識すると、パーフォリンやグランザイムなどのタンパク質を放出する。これらのタンパク質はアポトーシスを引き起こす。また、キラーT細胞はFasを刺激することでもアポトーシスを引き起こす。
また、マクロファージージがら放出されるサイトカインによってもアポトーシスが誘導される。マクロファージからは腫瘍壊死因子(TNF-α)が分泌され、これが細胞表面の受容体に結合することで細胞死を起こさせる。
また、これらのサイトカインはがん細胞を攻撃するNK細胞やキラーT細胞の働きを助ける役割もする。なお、キラーT細胞は細胞侵害性T細胞とも呼ばれている。
胎児性タンパクと腫瘍マーカー
胎児期に発現する細胞とがん細胞はいくつか類似している点がある。そのうちの一つとして、胎児期にしか発現しないはずのたんぱく質が、がん細胞で見つけることができるのである。
このように、腫瘍で発見される胎児性タンパクをがん胎児性タンパク質という。
がん胎児性タンパク質はそれぞれの腫瘍によって特異的である。つまり、腫瘍の種類が異なればがん胎児性タンパク質に違いの出るのである。例えば、肺がんと大腸がんでは、発現するがん胎児性タンパク質が異なっている。
p53 MUTATION DETECTION TEST
The TP53 chip scans exons 2-11, containing more than 98% of all mutations described so far in the gene. This system has been designed to allow the detection of most common mutations and all identified polymorphisms in the TP53 coding sequence. We found that this system allows for sequencing of an average of 97.5% of the arrayed TP53 gene. Altogether 1329 bp of sequence is analyzed from sense and anti-sense strand.
The TP53 chip detection limit for known alleles has been identified at 5%. The actual limit could sometimes be even less than 5%, but in real life the possible alleles are mostly unknown and reliable control and comparison with results obtained with standard methods can be technically difficult because of their own error rates.
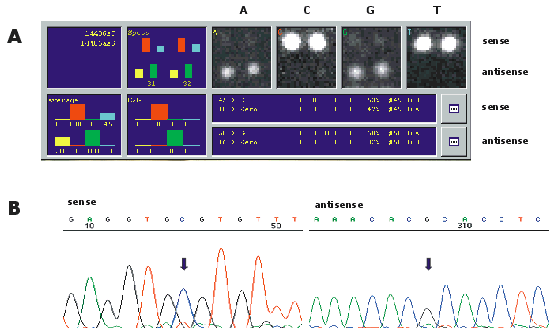
Missense mutation CGT>TGT (Arg273Cys) compared in APEX versus automated dideoxy sequencing. (A) First base of TP53 codon 273, analyzed by APEX-based sequencing. The signals corresponding to T in the sense strand and A in the antisense strand are indicative for mutation. (B) Automated dideoxy sequencing images corresponding to the Arg273Cys mutation from both DNA strands. The indicated mutation-specific peaks are in the range of the background noise and can be easily missed by visual analysis.
References
1. Evaluation of arrayed primer extension for TP53 mutation detection in breast and ovarian carcinomas.
Pedro Kringen, Anna Bergamaschi, Eldri Undlien Due, Yun Wang, Elda Tagliabue, Jahn M. Nesland, Aune Ahman, Neeme T?nisson, and Anne-Lise B?rresen-Dale.
BioTechniques, vol. 39 , no 5 (2005): pp 755-761
2. Evaluating the arrayed primer extension resequencing assay of TP53 tumor suppressor gene.
T?nisson, N., Zernant, J., Kurg, A., Pavel, H., Slavin, G., Roomere, H., Meie,l A., Hainaut, P., Metspalu, A.
Proc. Natl. Acad. Sci. USA, 2002, Vol. 99, Issue 8, pp. 5503-5508.
Requirements for the DNA samples
? the quality of the DNA needs to be ensured
? 300 ng of genomic DNA is required for p53 analysis
? Preferred concentration range of the DNA is 100-250 ng/ul
? DNA samples to be solved in pure sterile water
